Wasser
Wasser (H2O) ist eine chemische Verbindung aus Wasserstoff und Sauerstoff. Es kommt als einzige chemische Verbindung auf der Erde in natürlicher Form in allen drei Aggregatzuständen vor.
Der Begriff Wasser bezeichnet meist den flüssigen Zustand. Im festen Zustand wird es Eis und im gasförmigen Zustand Wasserdampf genannt.
Wasser ist die Grundlage des Lebens auf der Erde und stellt auch die Grundlage für den Tauchsport selbst dar.
Inhaltsverzeichnis
Grundwissen für Open Water Diver* (OWD*)
Wasser bedeckt knapp 71% der Erdoberfläche. Es bildet die Grundlage für alles bekannte Leben auf dem Planeten Erde. Selbst der menschliche Körper besteht zu 50% bis 75% aus Wasser.
In der Natur kommt Wasser in seiner reinen Form so gut wie nicht vor, sondern es enthält immer gelöste Gase und Salze. Liegt der Salzanteil unter 0,1% spricht man von Süßwasser. Dessen Dichte beträgt ziemlich genau 1 kg pro Liter.
Das Salzwasser der Meere und Ozeane enthält einen durchschnittlichen Massenanteil von 3,5% an gelösten Salzen. Salzwasser hat deshalb eine höhere Dichte als Süßwasser, was zu einem größeren Auftrieb und folglich dazu führt, dass man im Meer bei gleicher Ausrüstungskonfiguration mehr Taucherblei mitführen muss.
Expertenwissen (DM***)
Dichteanomalie
Aufgrund des Aufbaus des Wassermoleküls zeigt Wasser zwei Eigenschaften, die bei sehr wenigen anderen Stoffen auftreten: Im flüssigen Zustand nimmt mit abnehmender Temperatur seine Dichte zu, aber nur bis zu etwa 4°C. Zwischen 4°C und dem Gefrierpunkt bei 0°C nimmt seine Dichte ab. Dies bezeichnet man als Dichteanomalie. Im festen Zustand verhält sich der Verlauf der Dichte über die Temperatur zwar nicht annormal, allerdings ist die Dichte von Eis etwa 7% geringer als die von flüssigem Wasser. Deshalb schwimmt Eis an der Wasseroberfläche, wobei sich jedoch ein Großteil des Eisvolumens unter Wasser befindet.
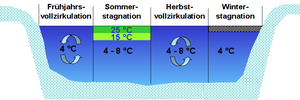
Diese beiden Eigenschaften haben einen entscheidenden Einfluss auf die Gewässer und auf das Leben in ihnen. Sobald das Oberflächenwasser im Winter unter 4°C abkühlt, sinkt es wegen seiner abnehmenden Dichte nicht nach unten, sondern bleibt an der Oberfläche und gefriert anschließend. Eis hat eine noch geringere Dichte als das kalte Wasser und schwimmt an der Oberfläche. In der Tiefe sammelt sich das Wasser mit der höchsten Dichte, d. h. dort herrschen auch bei gefrorener Oberfläche 4°C. Im Sommer verhält es sich umgekehrt: Das kälteste und somit dichteste Wasser mit einer Temperatur von 4°C sammelt sich am Grund, und das wärmere, leichtere Wasser befindet sich an der Oberfläche. Je nach Oberflächentemperatur kann es zu starken Sprungschichten mit Temperatursprüngen von 5°C bis 8°C kommen in denen das Wasser schlierig wirkt. Die Sichtweiten können sich in den Schichten darüber und darunter stark unterscheiden.
Im Frühjahr, wenn der gesamte Wasserkörper etwa die gleiche Temperatur (ca. 4°C) hat, genügt schon ein leichter Wind, das ganze Wasser umzuschichten (sog. Frühjahrskonvektion). So gelangt Sauerstoff bis zum Grund. Im Sommer befindet sich das warme Wasser an der Oberfläche und verhindert den Sauerstoffzustrom in tiefere Wasserschichten (sog. Sommerstagnation). Das kann bei stark überdüngten Gewässern zu einem Sauerstoffmangel und zur Bildung von giftigem Schwefelwasserstoff in der Tiefe führen. Bei abnehmender Temperatur im Herbst beginnt analog zum Frühjahr die sog. Herbstkonvektion. Im Winter schließt dann eine Eisdecke die Oberfläche, was zur Winterstagnation führt.
Aggregatzustandsänderungen und Celsius-Temperaturskala
Kühlt sich Wasserdampf ab, beginnt er bei 100°C zu kondensieren. Die Temperatur bleibt dabei solange konstant, bis aller Dampf zu Wasser kondensiert ist. Kühlt sich das Wasser weiter ab, beginnt es bei 0°C zu Eis zu erstarren. Auch hier bleibt die Temperatur solange konstant, bis das gesamte Wasser gefroren ist. Diese beiden Haltepunkt werden in der Celsius-Temperaturskala als Fixpunkte für eine 100-teilige Skala benutzt: Der Schmelzpunkt liegt bei 0°C, der Siedepunkt bei 100°C.
Diese beiden Temperaturen gelten für reines Wasser. Sobald im Wasser Salze gelöst sind, sinkt der Erstarrungspunkt ab. Meerwasser gefriert beispielsweise erst bei einer Temperatur von knapp -2°C. Eine gesättigte, 100%-ige Kochsalzlösung hat einen Schmelzpunkt von -21°C.